Im menschlichen Embryo entwickeln sich die endokrinen Zellen der Langerhans-Inseln aus den epithelialen Pankreas-Vorläuferzellen. Der Transkriptionsfaktor Neurogenin3 ist für die Differenzierung wichtig. Nur mit seiner Hilfe können sich etwa die insulinproduzierenden Betazellen bilden. Mutationen im Neurogenin-3-Gen führen zu Diabetes. Forschende haben eine Methode entwickelt, mit der sie die Expression des Neurogenin-3-Gens in menschlichen Pankreaszellen beobachten können. So entdeckten sie, dass schon eine schwache Expression die Bildung von Betazellen ermöglicht, um Diabetes vorbeugen zu können.
Die Langerhans-Inseln der Bauchspeicheldrüse enthalten verschiedene endokrine Zellen, die für die Regulation des Kohlenhydratstoffwechsels wichtige Hormone produzieren. Während die Betazellen das blutzuckersenkende Hormon Insulin bilden, produzieren die Alphazellen zum Beispiel seinen Gegenspieler Glukagon.
Neurogenin-3 entscheidend für Differenzierung
Der Transkriptionsfaktor Neurogenin-3 sorgt in der Entwicklung der Bauchspeicheldrüse für die Differenzierung dieser endokrinen Zelltypen aus den epithelialen Vorläuferzellen des Pankreas. Die höchste Konzentration von Neurogenin3 findet sich deshalb in der Phase der frühen Organogenese, zur Geburt hin nimmt sie deutlich ab. In Bauchspeicheldrüsen von Erwachsenen findet sich praktisch kein Neurogenin-3 mehr.
Forschende des Max-Planck-Instituts für molekulare Zellbiologie und Genetik in Dresden und des DZD-Partners Paul-Langerhans-Institut Dresden von Helmholtz Munich am Universitätsklinikum Carl Gustav Carus der TU Dresden sowie der Novo Nordisk Foundation an der Universität Kopenhagen haben untersucht, wie sich Neurogenin-3 in einzelnen Zellen verhält.
Schwache Expression reicht aus
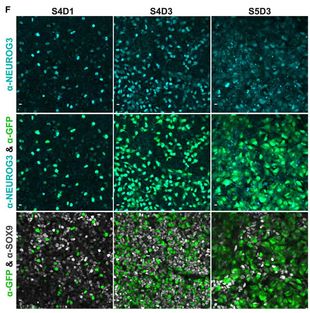
Sie entwickelten 2- und 3-dimensionale Modelle aus jungen menschlichen Pankreaszellen, in denen sie Neurogenin3 mittels spezieller Marker lokalisieren können. So entdeckten sie, dass das Neurogenin-3-Gen in verschiedenen Pankreaszellen unterschiedlich exprimiert wird. Einige Zellen exprimieren das Gen stark, andere nur schwach. Überraschend für die Forschenden: Trotz der unterschiedlich starken Expression waren alle Pankreaszellen endokrin aktiv und bildeten Hormone.
Offenbar sind selbst kleine Mengen Neurogenin-3 ausreichend, um die Differenzierung in endokrine Zellen anzustoßen und zum Beispiel Betazellen zu bilden. Das ist den Forschenden zufolge wichtig, denn es erklärt, weshalb Mutationen mit geringerer Wirkung im Neurogenin-3-Gen bei Menschen noch keinen Diabetes auslösen. Nur Mutationen, die die Funktion des Gens stark beeinträchtigen, führen zu Diabetes.
Betazellentstehung braucht Zeit
Und eine weitere Erkenntnis: Neurogenin3 arbeitet bei Menschen langsamer als bei Mäusen. Für die Forschenden ist dies ein Hinweis darauf, dass dieses Gen bei Menschen mehr Zeit braucht, um seine Aufgabe zu erfüllen. Die Differenzierung epithelialer Vorläuferzellen in Beta- oder Alphazellen erfordert bei Menschen doppelt so viel Zeit wie bei den Nagern.
Die von den Forschenden entwickelten Zellkultursysteme helfen dabei, besser zu verstehen, wie Zellen in menschlichen Embryonen Organe bilden. Die Beobachtung von Neurogenin-3 in einzelnen Zellen zeigt, wie die Aktivität bestimmter Gene während der embryonalen Entwicklung zu Diabetes im späteren Leben führen kann.
Original-Publikation:
Belin Selcen Beydag-Tasöz, Joyson Verner D’Costa, Lena Hersemann, Byung Ho Lee, Federica Luppino, Yung Hae Kim, Christoph Zechner, Anne Grapin-Botton. Integrating single-cell imaging and RNA sequencing datasets links differentiation and morphogenetic dynamics of human pancreatic endocrine progenitors. Developmental Cell 2023 Aug 16; doi: 10.1016/j.devcel.2023.07.019