Adipositas, Diabetes und Magen-Darm-Krebs stehen oft mit einer ungesunden Ernährung in Verbindung. Welche molekularen Mechanismen dafür verantwortlich sind, ist nicht vollständig geklärt. Forschende des DZD und des Helmholtz Zentrums München haben neue Erkenntnisse gewonnen, die helfen, diesen Zusammenhang besser zu verstehen. Sie sind eine wichtige Basis für die Entwicklung nicht-invasiver Therapien.
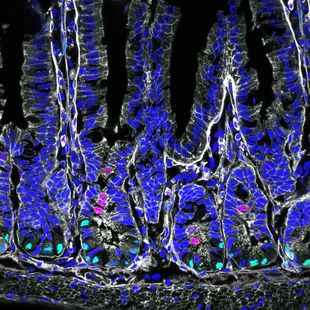
Der Darm ist essentiell für die Aufrechterhaltung unseres Energiehaushaltes und ein Meister darin, schnell auf Veränderungen in der Ernährung und im Nährstoffhaushalt zu reagieren. Dies macht er mithilfe von Darmzellen, die unter anderem spezialisiert sind auf die Absorption der Nahrungsbestandteile oder die Sekretion von Hormonen. Beim erwachsenen Menschen bilden sich die Darmzellen alle fünf bis sieben Tage neu. Die Fähigkeit zur ständigen Erneuerung und zur Ausbildung jeglicher Darmzellarten aus Darmstammzellen ist entscheidend für die natürliche Anpassungsfähigkeit des Verdauungsorgans. Bei einer dauerhaften stark zucker- und fettreichen Ernährung ist jedoch diese Anpassung gestört und kann zur Entwicklung von Adipositas, Typ-2-Diabetes und Magen-Darm-Krebs beitragen.
Die molekularen Mechanismen hinter dieser Fehlanpassung gehören zum Forschungsgebiet von Heiko Lickert und seiner Gruppe am Helmholtz Zentrum München. Die Wissenschaftler:innen gehen davon aus, dass Darmstammzellen eine besondere Rolle bei der Fehlanpassung spielen. Mithilfe eines Mausmodells untersuchten die Forschenden die Auswirkungen einer zucker- und fettreiche Ernährung und verglichen sie mit einer Kontrollgruppe.
Von der hochkalorischen Diät zum erhöhten Risiko für Magen-Darm-Krebs
„Als erstes stellten wir fest, dass sich der Dünndarm bei der hochkalorischen Diät stark vergrößert, sagt Studienleiterin Anika Böttcher. „Gemeinsam mit den Experten für Computational Biology bei uns am Zentrum haben wir ein Profil von 27.000 Darmzellen von Mäusen erstellt. Mittels neuer Machine-Learning-Techniken fanden wir so heraus, dass sich Darmstammzellen bei den Mäusen mit ungesunder Diät deutlich schneller teilen und differenzieren.“ Die Forschenden gehen davon aus, dass dies auf eine Hochregulierung der entsprechenden Signalwege zurückzuführen ist, die bei vielen Krebsarten mit einer Beschleunigung des Tumorwachstums in Verbindung steht. „Dies könnte ein wichtiger Zusammenhang sein: Die Ernährung beeinflusst die Stoffwechselsignale, was zu einem übermäßigen Wachstum von Darmstammzellen und schließlich zu einem erhöhten Risiko für Magen-Darm-Krebs führt“, so Böttcher.
Mithilfe dieser hochauflösenden Technik konnten die Forschenden auch seltene Zellarten im Darm untersuchen, zum Beispiel hormonabsondernde Zellen. So konnten sie unter anderem zeigen, dass eine ungesunde Diät zu einer Verringerung der serotonin-produzierenden Zellen im Darm führt. Des Weiteren zeigte die Studie, dass sich die absorbierenden Zellen an die fettreiche Diät anpassen und ihre Funktionalität erhöhen und so direkt eine Gewichtszunahme begünstigen.
Wichtige Grundlagenforschung für nicht-invasive Therapien
Diese und weitere Erkenntnisse aus der Studie führen zu einem neuen Verständnis von Krankheitsmechanismen im Zusammenhang mit einer hochkalorischen Diät. „Was wir herausgefunden haben, ist von entscheidender Bedeutung, um alternative nicht-invasive Therapien zu entwickeln“, fasst Studienleiter Heiko Lickert die Ergebnisse zusammen. Dies könnte beispielsweise auf hormoneller Ebene geschehen durch gezielte Regulation des Serotoninspiegels. Diesen und weitere Ansätze wird die Forschungsgruppe in nachfolgenden Studien überprüfen.
Original-Publikation:
Aliluev et al., 2021: Diet-induced alteration of intestinal stem cell function underlies obesity and prediabetes in mice. Nature Metabolism, DOI: 10.1038/s42255-021-00458-9