München/Tübingen, 07.02.2023
NAFLD: Rolle der Hepatokine bei der Identifizierung von Subtypen
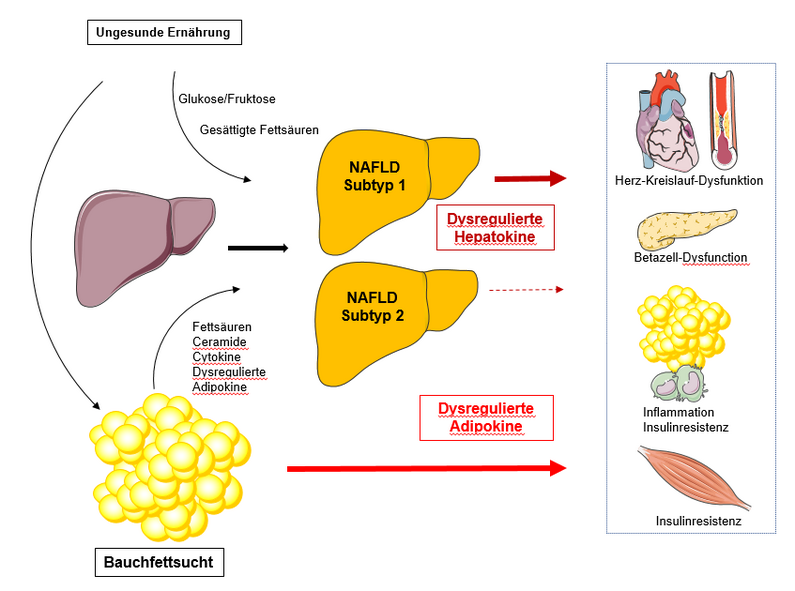
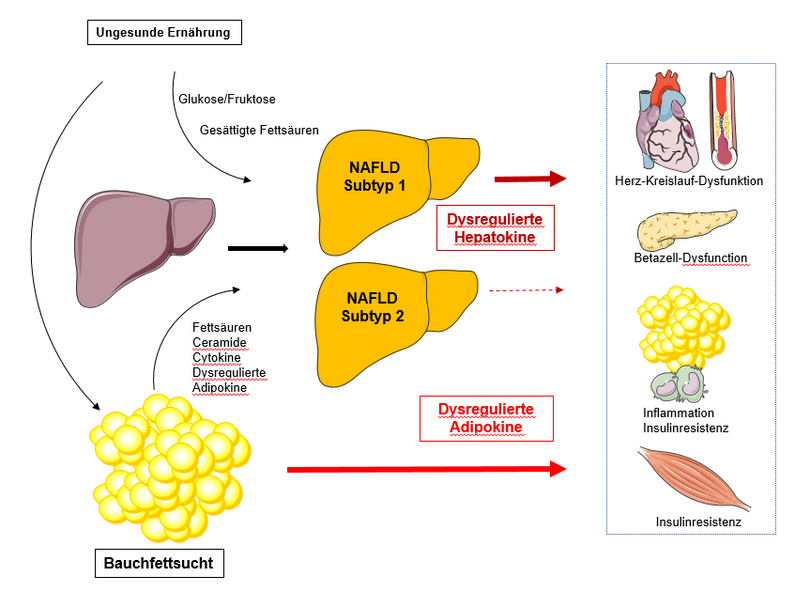
Die nicht-alkoholische Fettlebererkrankung (NAFLD) ist ein wichtiger Risikofaktor für Typ-2-Diabetes und für Herz-Kreislauf-Erkrankungen. In einem Beitrag in Cell Metabolism beleuchten Norbert Stefan von der Universität Tübingen, Helmholtz Munich und vom Deutschen Zentrum für Diabetesforschung, Morris F. White von der Harvard Medical School und Kollegen zunächst die Dysregulation von Hepatokinen bei Menschen mit NAFLD. Hepatokine sind Proteine, welche die Leber freisetzt. Anschließend erörtern sie Pathomechanismen von Typ-2-Diabetes und von kardiovaskulären Erkrankungen, die speziell mit NAFLD zusammenhängen, und fokussieren sich auf Wechselwirkungen zwischen Hepatokinen und Organen. Die Autoren schlagen vor, dass die Bestimmung der wichtigsten Hepatokine und Adipokine (Proteine aus Gewebefett) zur Identifizierung von NAFLD-Subtypen verwendet werden könnte, um die Präzisionsmedizin in der klinischen Praxis besser umzusetzen.
Weltweit leiden mehr als 25 % aller Erwachsenen und 3 bis 10 % aller Kinder an einer NAFLD. Der Prozentsatz ist wesentlich höher, wenn bei Erwachsenen (⁓60 %) und bei Kindern (⁓40 %) Übergewicht und/oder Diabetes vorliegen. Diese Zahlen sind alarmierend, da die NAFLD, insbesondere die nicht-alkoholische Steatohepatitis, die Hauptursache für chronische Lebererkrankungen und für Leberkrebs ist. Darüber hinaus zeigen Ergebnisse großer Studien, dass NAFLD mit einem ⁓2,5-fach erhöhten Risiko für Typ-2-Diabetes und einem ⁓1,5-fach erhöhten Risiko für kardiovaskuläre Ereignisse assoziiert ist. Doch über welche Mechanismen beeinflusst eine Fettleber die Entstehung von Typ-2-Diabetes und von Herz-Kreislauf-Erkrankungen? Und wie lässt sich die Auswirkung der Fettleber von der Auswirkung der zunehmend auftretenden abdominalen Adipositas, die häufig bei Menschen mit Fettleber zu finden ist, auf diese Krankheiten abgrenzen?
Mit diesen Fragen beschäftigen sich Forscher aus Tübingen und aus Boston seit vielen Jahren und haben dazu internationale Kooperationen aufgebaut, so ist Norbert Stefan als Visiting Professor an der Harvard Medical School. Sie haben wichtige Hepatokine identifiziert, die bei NAFLD dysreguliert sind, und ihre Rolle im Stoffwechsel beschrieben.
© N. Stefan
„Wir fanden heraus, dass das Hepatokin Fetuin-A vermehrt von der Fettleber produziert wird und dass es das Auftreten von Typ-2-Diabetes und von kardiovaskulären Ereignissen klar prognostiziert. Wir haben auch Mechanismen der zellulären Wirkung von Fetuin-A zur Förderung der Insulinresistenz, der subklinischen Entzündungen und der Beeinträchtigung der Insulinsekretion identifiziert“, betont Professor Norbert Stefan. Und Professor Morris White fügt hinzu: „Wir haben ein weiteres wichtiges Hepatokin nachgewiesen, das zunehmend von der Fettleber produziert wird – Follistatin. Außerdem haben wir Mechanismen gefunden, welche die Produktion von Follistatin in der Leber hochregulieren beziehungsweise durch die Follistatin den Glukosespiegel und die Insulinresistenz erhöht. In großen Humankohorten haben wir gesehen, dass Follistatin mit einem erhöhten Risiko für Typ-2-Diabetes verbunden ist.“ In ihrem aktuellen Artikel beschreiben die Forscher Wirkmechanismen dieser Hepatokine und fassen das Wissen über andere Hepatokine zusammen, die momentan untersucht werden.
Außerdem nutzten die Forschenden ein derzeit sehr beliebtes Instrument, die Clusteranalyse, um die enge Beziehung zwischen Fettleber und abdominaler Adipositas zu entschlüsseln und um Subtypen von Menschen mit Fettleber zu identifizieren. Bei Clusteranalysen werden Datensätze hinsichtlich ihrer Ähnlichkeit in Gruppen eingeteilt.
Indem sie mehrere Parameter, nämlich den Fettgehalt der Leber, die viszerale Fettmasse, das Hepatokin Fetuin-A und das Adipokin Adiponektin, zu Clustern zusammengefasst haben, gelang es ihnen, drei Cluster zu identifizieren. Die Cluster 1 und 3 wiesen eine ähnliche Insulinresistenz und einen erhöhten Leberfettgehalt auf, unterschieden sich jedoch weitgehend in den Plasmaspiegeln von Fetuin-A und Adiponektin. Daraus schlussfolgern die Wissenschaftler, dass sie Subtypen von Menschen mit einer Fettleber gefunden haben, die unterschiedliche Pathomechanismen der Insulinresistenz aufweisen. Sie vermuten, dass die Erforschung der Hepatokine hilfreich sein könnte, um in Zukunft weitere Subtypen der Fettleber zu identifizieren.
Original-Publikation:
Stefan N, Schick F, Birkenfeld AL, Häring HU, White MF. The role of hepatokines in NAFLD. Cell Metabolism (2023), https://doi.org/10.1016/j.cmet.2023.01.006
Wissenschaftliche Ansprechpartner:
Prof. Norbert Stefan
Deutsches Zentrum für Diabetesforschung e.V.
Helmholtz Zentrum München
Department Innere Medizin IV
Universitätsklinikum Tübingen
Otfried-Müller-Str. 10
72076 Tübingen
Telefon: +49-7071-2980390
E-Mail: norbert.stefan(at)med.uni-tuebingen.de
Prof. Morris F. White
Division of Endocrinology
Boston Children’s Hospital
Harvard Medical School
300 Longwood Ave, Boston MA 02115, USA
Telefon: +1-617-732-2578
E-Mail: morris.white(at)childrens.harvard.edu
Das Deutsche Zentrum für Diabetesforschung (DZD e.V.) ist eines der sechs Deutschen Zentren der Gesundheitsforschung. Es bündelt Experten auf dem Gebiet der Diabetesforschung und verzahnt Grundlagenforschung, Epidemiologie und klinische Anwendung. Ziel des DZD ist es, über einen neuartigen, integrativen Forschungsansatz einen wesentlichen Beitrag zur erfolgreichen, maßgeschneiderten Prävention, Diagnose und Therapie des Diabetes mellitus zu leisten. Mitglieder des Verbunds sind das Helmholtz Zentrum München – Deutsches Forschungszentrum für Gesundheit und Umwelt (Director: Professor Matthias Tschöp), das Deutsche Diabetes-Zentrum DDZ in Düsseldorf, das Deutsche Institut für Ernährungsforschung DIfE in Potsdam-Rehbrücke, das Institut für Diabetesforschung und Metabolische Erkrankungen des Helmholtz Zentrum München an der Eberhard-Karls-Universität Tübingen (IDM; Director: Professor Andreas Birkenfeld und das Paul-Langerhans-Institut Dresden des Helmholtz Zentrum München am Universitätsklinikum Carl Gustav Carus der TU Dresden, assoziierte Partner an den Universitäten in Heidelberg, Köln, Leipzig, Lübeck und München sowie weitere Projektpartner. www.dzd-ev.de
Helmholtz Munich ist ein biomedizinisches Spitzenforschungszentrum. Seine Mission ist, bahnbrechende Lösungen für eine gesündere Gesellschaft in einer sich schnell verändernden Welt zu entwickeln. Interdisziplinäre Forschungsteams fokussieren umweltbedingte Krankheiten, insbesondere die Therapie und die Prävention von Diabetes, Adipositas, Allergien und chronischen Lungenerkrankungen. Mittels künstlicher Intelligenz und Bioengineering transferieren die Forschenden ihre Erkenntnisse schneller zu den Patient:innen. Helmholtz Munich zählt mehr als 2.500 Mitarbeitende und hat seinen Sitz in München/Neuherberg. Es ist Mitglied der Helmholtz-Gemeinschaft, mit mehr als 43.000 Mitarbeitenden und 18 Forschungszentren die größte Wissenschaftsorganisation in Deutschland. Mehr über Helmholtz Munich (Helmholtz Zentrum München Deutsches Forschungszentrum für Gesundheit und Umwelt GmbH): www.helmholtz-munich.de
Pressekontakt

Birgit Niesing
niesing(at)dzd-ev.de
+49 (0)89 3187-3971

Dr. Astrid Glaser
glaser(at)dzd-ev.de
+49 (0)89 3187-1619
 |
