Neuherberg, 18.04.2017
Makrophagen lassen braunes Fettgewebe kalt
Braunes Fettgewebe gilt als pharmakologisch interessante Zielstruktur, um Adipositas zu behandeln. Aktiviert man das „gute“ braune Fett, wird der Stoffwechsel angekurbelt, und die „schlechten“ weißen Fettpolster werden abgebaut. Wissenschaftler um Dr. Timo Müller vom Helmholtz Zentrum München, Institut für Diabetes und Adipositas (IDO) und Partner im Deutschen Zentrum für Diabetesforschung (DZD), zeigen jetzt, dass Makrophagen diesen Vorgang nicht – wie früher angenommen – aktivieren. Ihre Veröffentlichung ist in Nature Medicine erschienen.
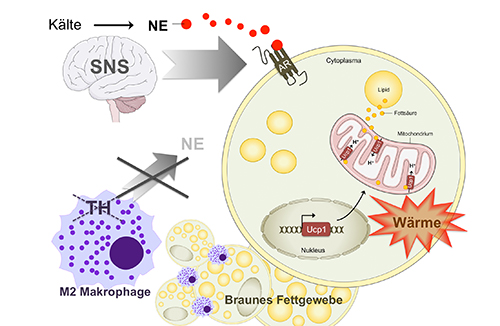
Braunes Fettgewebe produziert durch die Oxidation von Fettsäuren Wärme. Es ist nicht nur bei Neugeborenen zu finden, sondern in gewissem Umfang auch bei Erwachsenen. Das macht Zellen des braunen Fettgewebes zur interessanten Zielstruktur für Pharmakotherapien bei Adipositas. Bislang dachten Wissenschaftler, die Wärmebildung im braunen Fett würde auch über die Noradrenalinproduktion in bestimmten Immunzellen, sogenannten Makrophagen, aktiviert.
„Dieses bestehende Dogma konnten wir jetzt widerlegen“, sagt Katrin Fischer, Doktorandin am Institut für Diabetes und Adipositas, Helmholtz Zentrum München. Zusammen mit Dr. Timo Müller, Leiter der Pharmakologie am IDO, zeigte sie im Modell, dass bestimmte Immunzellen keinen Einfluss auf die Thermogenese haben. „Sogenannte M2-Makrophagen* sind nicht in der Lage, Noradrenalin zu synthetisieren“, ergänzt Müller. Sie besitzen nicht das notwendige Schlüsselhormon, die Tyrosinhydroxylase.
Durch ihre Experimente konnten Fischer und Müller zeigen, dass Versuche, braunes Fettgewebe über M2-Makrophagen zu aktivieren, nicht zum Erfolg führten. Verschiedene Pharmakotherapien zielen darauf ab, Oxidationsprozesse zu aktivieren, um Adipositas zu behandeln. Die weltweite Suche nach geeigneten Molekülen geht weiter. Die Studien, welche im renommierten Fachjournal Nature Medicine veröffentlicht wurden, sind Bestandteil einer großen internationalen Kooperation, besonders mit Prof. Christoph Buettner von dem ICAN School of Medicine at Mount Sinai, New York.
Weitere Informationen
Originalpublikation:
Katrin Fischer et al. (2017), Alternatively activated macrophages do not synthesize catecholamines or contribute to adipose tissue adaptive thermogenesis. Nature Medicine, doi:10.1038/nm.4316.
An den Arbeiten waren neben dem Institut für Diabetes und Adipositas (IDO) des Helmholtz Zentrums München u.a. das Diabetes, Metabolism and Obesity Institute und die Icahn School of Medicine at Mount Sinai, New York, beteiligt.
*Makrophagen gehören zu den Zellen des Immunsystems. M1-Makrophagen fördern Entzündungen, während diejenigen, die Entzündungen verringern und die Gewebereparatur fördern, M2-Makrophagen genannt werden Dieser Unterschied spiegelt sich in ihrem Stoffwechsel wider. M1-Makrophagen haben die Fähigkeit, aus Arginin Stickstoffmonoxid zu synthetisieren, während M2-Makrophagen die einzigartige Fähigkeit haben, aus Arginin das „Reparaturmolekül“ Ornithin herzustellen.
Das Helmholtz Zentrum München verfolgt als Deutsches Forschungszentrum für Gesundheit und Umwelt das Ziel, personalisierte Medizin für die Diagnose, Therapie und Prävention weit verbreiteter Volkskrankheiten wie Diabetes mellitus und Lungenerkrankungen zu entwickeln. Dafür untersucht es das Zusammenwirken von Genetik, Umweltfaktoren und Lebensstil. Der Hauptsitz des Zentrums liegt in Neuherberg im Norden Münchens. Das Helmholtz Zentrum München beschäftigt rund 2.300 Mitarbeiter und ist Mitglied der Helmholtz-Gemeinschaft, der 18 naturwissenschaftlich-technische und medizinisch-biologische Forschungszentren mit rund 37.000 Beschäftigten angehören.
Das Institut für Diabetes und Adipositas (IDO) erforscht die Erkrankungsmechanismen des Metabolischen Syndroms mit systembiologischen und translationalen Ansätzen. Mittels zellulärer Systeme, genetisch modifizierter Mausmodelle und klinischer Interventionsstudien sollen neue Signalwege und Zielstrukturen entdeckt werden. Ziel ist die interdisziplinäre Entwicklung innovativer Therapieansätze zur personalisierten Prävention und Behandlung von Adipositas, Diabetes und deren Begleiterkrankungen. Das IDO ist Teil des Helmholtz Diabetes Center (HDC).
Ansprechpartner für die Medien:
Abteilung Kommunikation
Helmholtz Zentrum München -
Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH)
Ingolstädter Landstraße 1
85764 Neuherberg
Tel.: +49 89 3187-2238
presse(at)helmholtz-muenchen.de
Fachlicher Ansprechpartner:
Dr. Timo Müller
Helmholtz Zentrum München - Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH)
Institut für Diabetes und Adipositas
Ingolstädter Landstraße 1
85764 Neuherberg
Tel. +49 821 598 2106
timo.mueller(at)helmholtz-muechen.de
Pressekontakt

Birgit Niesing
niesing(at)dzd-ev.de
+49 (0)89 3187-3971
 |
